Tinjauan Umum Mengenai Antibodi :
Pengertian Antibodi
Antibodi, juga dikenal sebagai imunoglobulin, adalah protein yang diproduksi oleh limfosit sebagai hasil interaksi dengan antigen . Antibodi adalah bagian dari kekebalan humoral dari sistem kekebalan adaptif di mana setiap antibodi mengidentifikasi antigen tertentu dan melindungi tubuh terhadapnya.
- Antibodi adalah glikoprotein yang mengikat antigen dengan tingkat spesifisitas dan afinitas yang tinggi.
- Limfosit B dirangsang oleh pengikatan antigen, yang menghasilkan sekresi jutaan antibodi dalam aliran darah.
- Antibodi yang diproduksi bersirkulasi melalui aliran darah dan menetralkan antigen yang identik dengan yang memicu respons imun.
- Pengikatan antibodi ke mikroorganisme atau antigen lainnya dapat menyebabkan mikroorganisme tidak bergerak atau mencegahnya menembus sel.
- Antibodi menjalankan dua fungsi utama dalam sistem kekebalan. Fungsi pertama adalah pengenalan dan pengikatan benda asing. Fungsi kedua yang lebih penting adalah memicu penghapusan bahan asing yang menempel.
- Karena jutaan antibodi diproduksi selama respons imun, beberapa di antaranya tetap beredar di darah selama beberapa bulan. Ini memberikan kekebalan yang diperpanjang terhadap antigen tertentu.
- Setiap antibodi adalah protein berbentuk Y di mana setiap ujung Y berisi paratope yang mengenali epitop dari antigen tertentu.
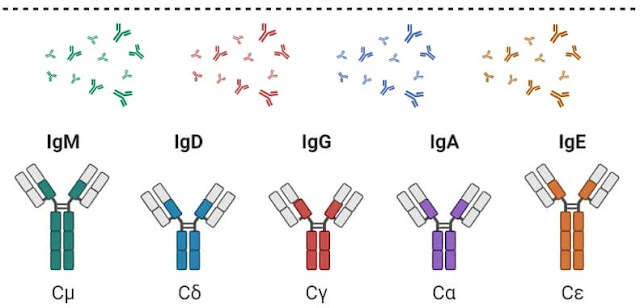
- Antibodi dapat diklasifikasikan ke dalam kelas yang berbeda berdasarkan struktur dan fungsi yang berbeda.
Struktur Antibodi
- Antibodi adalah protein plasma globular dengan struktur dasar berbentuk Y dan empat polipeptida.
- Ada dua rantai berat identik dan dua rantai ringan identik yang dihubungkan bersama oleh ikatan disulfida. Rantai ringan terdiri dari polipeptida berukuran 22.000 Da, dan rantai berat terdiri dari polipeptida dengan ukuran 50.000 Da.
- Setiap rantai berat dihubungkan ke rantai ringan dengan ikatan disulfida, dan dua rantai berat dihubungkan ke rantai ringan dengan dua ikatan sulfida.
- Ada lima jenis rantai berat pada mamalia yang ditandai dengan huruf: α, δ, γ, ε dan µ. Ada dua jenis rantai ringan yang ditetapkan oleh λ dan κ.
- Antibodi terdiri dari wilayah variabel dan wilayah konstan. Daerah variabel berubah menjadi berbagai struktur tergantung pada perbedaan antigen. Daerah konstan konstan dan tidak berubah dengan antigen.
- Wilayah variabel bervariasi antara klon dan terlibat dalam pengenalan antigen. Wilayah konstan dikonservasi di antara klon dan diperlukan untuk integritas struktural dan fungsi efektor.
- Rantai berat dan ringan dalam molekul imunoglobulin terdiri dari daerah variabel terminal-amino dengan 100-110 asam amino.
- Setiap rantai berat memiliki satu domain variabel dan satu domain konstan. Rantai ringan, pada gilirannya, terdiri dari satu domain variabel dan tiga domain konstan.
- Sisa rantai terdiri dari daerah konstan, variasi terbatas yang menentukan subtipe rantai ringan.
- Rantai berat di beberapa antibodi mengandung daerah engsel yang kaya prolin. Daerah engsel memisahkan domain pengikat antigen dan domain efektor.
- Wilayah tersebut memungkinkan pergerakan domain yang memungkinkan mereka untuk mengikat antigen yang dipisahkan oleh jarak yang berbeda-beda.
Jenis atau Kelas Antibodi
- Antibodi dapat diklasifikasikan menjadi lima kelas yang berbeda; IgG, IgM, IgA, IgD, dan IgE. Semua antibodi memiliki struktur dasar antibodi empat rantai, tetapi memiliki rantai berat yang berbeda.
- Perbedaan imunoglobulin lebih terlihat di daerah Fc dari antibodi, yang mengarah pada pemicuan fungsi efektor yang berbeda.
- Perbedaan struktural pada antibodi juga menyebabkan perbedaan keadaan polimerisasi unit monomer.
- Berikut ini adalah lima kelas antibodi yang berbeda;
Imunoglobulin G (IgG)
IgG adalah imunoglobin paling melimpah, yang menyumbang sekitar 80% dari total antibodi serum. Konsentrasi IgG dalam darah sekitar 10mg / ml.
Struktur IgG
- Struktur dasar IgG terdiri dari protein berbentuk Y di mana lengan Fab dihubungkan ke lengan Fc oleh wilayah rantai polipeptida yang diperpanjang yang disebut engsel.
- Wilayah tersebut terpapar dan sensitif terhadap serangan oleh protease yang membelah molekul menjadi unit fungsional berbeda yang diatur dalam struktur empat rantai.
- Molekul IgG terdiri dari dua rantai berat identik, biasanya berukuran 50kDa.
- Rantai ringan di IgG memiliki dua bentuk; κ dan λ, di mana bentuk κ lebih umum daripada λ, dalam kasus manusia.
- Daerah Fc molekul memiliki situs N-glikosilasi yang sangat kekal dalam rantai berat.
Sifat IgG
- Antibodi IgG hadir dalam serum dalam bentuk monomer, dan ini dapat melintasi plasenta dari ibu ke janin.
- Setiap antibodi IgG memiliki dua paratop yang mengikat dua epitop berbeda pada antigen yang berbeda.
- IgG memiliki empat subclass yang diklasifikasikan berdasarkan subclass rantai berat γ.
- Antibodi IgG berpartisipasi terutama dalam respon imun sekunder karena ini dihasilkan sebagai hasil dari peralihan kelas dan pematangan respon.
- Subclass dari IgG
- Antibodi IgG telah diklasifikasikan menjadi empat subkelas; IgG1, IgG2, IgG3, dan IgG4.
- Ini dinamai berdasarkan urutan kelimpahannya dalam serum, dengan IgG1 menjadi yang paling melimpah.
IgG1
- IgG1 adalah subkelas antibodi IgG yang paling melimpah dengan rantai berat γ1.
- IgG1 terutama diinduksi oleh antigen protein larut dan protein membran tetapi sering disertai oleh subkelas lebih rendah lainnya.
- Kekurangan IgG1 dapat menyebabkan penurunan kadar IgG total karena merupakan subkelas yang paling melimpah.
IgG2
- IgG2 adalah IgG paling melimpah kedua dalam serum manusia, dan terdiri dari γ2 rantai berat.
- IgG2 hampir seluruhnya bertanggung jawab atas respons terhadap antigen polisakarida kapsuler bakteri.
- IgG2 adalah satu-satunya subkelas antibodi IgG yang tidak dapat melewati plasenta selama kehamilan.
- Kekurangan IgG2 dapat mengakibatkan pertahanan yang lemah terhadap mikroorganisme patogen.
IgG3
- IgG3 adalah IgG paling melimpah ketiga yang terjadi di serum manusia dengan rantai berat γ3.
- Ini sangat efektif dalam menginduksi fungsi efektor. Ini adalah antibodi proinflamasi yang kuat dengan waktu paruh yang lebih pendek.
- IgG3 juga merupakan aktivator komplemen yang paling efektif dan memiliki afinitas tinggi untuk FcR pada sel fagositik, membantu dalam opsonisasi.
IgG4
- IgG4 adalah antibodi IgG yang paling sedikit melimpah dalam serum manusia, terdiri dari subkelas rantai berat γ4.
- IgG4 diinduksi oleh alergen, dan itu terbentuk setelah paparan antigen berulang atau jangka panjang dalam pengaturan non-infeksi.
- IgG4 dapat melewati plasenta dan berpindah dari ibu ke janin. Defisiensi IgG4 cukup jarang, tetapi peningkatan kadar IgG4 dalam serum telah dikaitkan dengan sejumlah masalah pada organ yang berbeda.
Fungsi IgG
- Antibodi IgG memberikan perlindungan jangka panjang terhadap berbagai agen seperti bakteri, virus, dan racun bakteri.
- IgG adalah salah satu aktivator komplemen yang paling kuat jika dibandingkan dengan semua antibodi lainnya.
- Kemampuan pengikatan IgG ke antigen lebih efektif karena meningkatkan fagositosis.
Imunoglobulin M (IgM)
IgM adalah imunoglobulin terbanyak ketiga dalam serum, dengan konsentrasi 1,5 mg / ml. Ini adalah antibodi terbesar dan merupakan antibodi pertama yang muncul sebagai respons terhadap paparan awal antigen.
Struktur IgM
- IgM disekresikan dalam bentuk pentamerik dengan lima unit berbeda, di mana masing-masing terdiri dari dua µ rantai berat dan dua rantai ringan.
- Rantai AJ mungkin ada dalam bentuk molekul heksamerik, tetapi tidak selalu ada. Rantai J biasanya ditambahkan tepat sebelum sekresi pentamer karena membantu dalam polimerisasi monomer.
- Masing-masing monomer memiliki dua situs pengikatan antigen, menghasilkan 10 domain pengikatan dalam satu molekul. Namun, semua domain tidak dapat ditempati secara bersamaan karena keterbatasan ruang.
- Bentuk pentamerik IgM memiliki berat molekul 900 kDa.
Sifat IgM
- IgM adalah antibodi pentamerik terbesar dan satu-satunya pada manusia. Ini juga merupakan antibodi pertama yang diproduksi sebagai respons terhadap paparan awal antigen.
- IgM adalah imunoglobulin pertama yang disintesis oleh janin, dimulai pada usia sekitar 20 minggu.
- IgM adalah molekul pentamerik dengan 10 situs pengikatan antigen dan 5 bagian Fc yang disatukan oleh hubungan disulfida.
- Bentuk monomer IgM terjadi sebagai reseptor antibodi utama pada permukaan limfosit B.
- IgM relatif berumur pendek dan biasanya menghilang lebih awal dari IgG.
- Ukuran besar molekul tidak memungkinkan difusi efektif dari antibodi, dan dengan demikian, ditemukan dalam konsentrasi yang sangat rendah dalam cairan intraseluler.
Fungsi IgM
- IgM sangat efektif melawan virus karena IgM yang lebih sedikit dari IgG sudah cukup untuk menetralkan infeksi virus.
- IgM juga merupakan aglutinin yang lebih baik karena membutuhkan 100 hingga 1000 lebih banyak molekul IgG daripada IgM untuk tingkat aglutinasi yang sama.
- IgM terlibat dalam mengaktifkan jalur klasik komplemen dalam sistem kekebalan karena adanya dua daerah Fc yang berdekatan.
Imunoglobulin A (IgA)
IgA atau sIgA adalah imunoglobulin utama yang terdapat pada selaput lendir dalam bentuk antibodi sekretori. Konsentrasi IgA ditemukan dalam jumlah kecil dalam darah, tetapi konsentrasi tinggi ditemukan dalam air mata, air liur, dan keringat.
Struktur IgA
- Ukuran molekul IgA adalah 160 kDa dengan struktur monomer empat rantai, namun dapat terjadi dalam bentuk dimer dan trimer.
- Rantai berat IgA dapat dibagi menjadi tiga domain konstan, CH1, CH2, dan CH3, dan domain variabel VH.
- Daerah engsel terjadi antara domain CH1 dan CH2 yang disatukan oleh hubungan disulfida.
- sIgA memiliki komponen sekretori sebagai komponen tambahan dengan rantai polipeptida 75 kDa dan fragmen proteolitik ekstraseluler.
- Molekul tersebut juga memiliki rantai-J yang terhubung ke rantai melalui jembatan disulfida. Sekretori dan rantai J memfasilitasi pengangkutan IgA melintasi sel epitel dan melindungi molekul dari pencernaan proteolitik oleh enzim.
Sifat IgA
- IgA adalah imunoglobulin terbanyak kedua pada manusia, dengan konsentrasi 2-4 mg / ml. Ini menyumbang sekitar 10-15% dari total konsentrasi serum tetapi merupakan antibodi yang paling melimpah di sekresi eksternal.
- IgA adalah garis pertahanan pertama karena bekerja dengan menghambat adhesi bakteri dan virus ke sel epitel dan dengan menetralkan racun virus dan bakteri secara intraseluler.
- IgA sekretori sebagian besar terjadi dalam bentuk dimer dengan dua unit monomer yang dihubungkan bersama oleh peptida yang bergabung.
Subclass dari IgA
- IgA telah diklasifikasikan menjadi dua subclass; IgA1 dan IgA2.
- IgA1 adalah bentuk monomer, dan IgA2 adalah bentuk dimmer atau polimer.
- IgA1 terjadi dalam serum IgA (sekitar 80%), yang diproduksi di sumsum tulang dan dilepaskan di permukaan mukosa.
- IgA di sebagian besar produk yang disekresikan secara lokal adalah polimer dengan pelepasan relatif IgA2 dimer.
- Salah satu perbedaan paling menonjol antara IgA1 dan IgA2 adalah daerah engsel yang cukup diperpanjang di IgA1.
Fungsi IgA
- IgA adalah garis pertahanan pertama karena melindungi tubuh dari masuk dan kolonisasi permukaan mukosa oleh partikel asing yang berbeda.
Imunoglobulin D (IgD)
IgD adalah antibodi monomer yang terjadi pada permukaan limfosit B imatur. Ini diproduksi dalam bentuk yang disekresikan dalam jumlah kecil dalam serum darah.
Struktur IgD
- IgD memiliki keragaman struktural selama evolusi pada vertebrata karena bersifat fleksibel untuk melengkapi fungsi IgM.
- Ini adalah glikoprotein dengan dua rantai berat δ identik dan dua rantai ringan identik.
- IgD yang ditemukan di permukaan limfosit B memiliki beberapa asam amino ekstra di terminal-C untuk berlabuh ke membran.
- Rantai ringan dan berat dihubungkan bersama oleh tautan disulfida, tetapi mereka memiliki tautan disulfida intrachain tambahan yang membagi rantai menjadi domain.
- Molekul IgD juga memiliki daerah engsel yang diperpanjang yang meningkatkan fleksibilitas molekul tetapi menurunkan ketahanannya terhadap pembelahan proteolitik.
Sifat IgD
- IgD ditemukan dalam konsentrasi rendah dalam serum, dan fungsi pastinya dalam sistem kekebalan belum dipahami dengan jelas.
- Ini mewakili sekitar 0,25% dari total serum imunoglobulin dengan massa molekul relatif 185 kDa dan waktu paruh 2,8 hari.
- Ini juga menyumbang sekitar 1% dari protein yang ada di membran plasma limfosit B. Di sini, biasanya diekspresikan bersama dengan antibodi permukaan sel lain, IgM.
Fungsi IgD
- Fungsi IgD yang paling penting adalah reseptor antigen pada sel B. Ia juga mengatur fungsi sel B ketika bertemu dengan antigen.
- Ia juga disekresikan dalam jumlah tertentu di dalam darah, sekresi mukosa, dan permukaan sel efektor imun bawaan.
Imunoglobulin E (IgE)
IgE adalah sejenis imunoglobulin yang hanya ditemukan pada mamalia dan disintesis oleh sel plasma. Itu terjadi dalam bentuk monomer dengan dua rantai berat ε dan dua rantai ringan.
Struktur IgE
- IgE memiliki struktur antibodi yang khas dengan ε rantai berat yang memiliki kandungan karbohidrat tinggi.
- IgE memiliki dua situs pengikatan antigen identik yang terdiri dari rantai ringan dan berat serta valensi 2.
- Seperti semua antibodi, rantai berat dan ringan dibagi lagi menjadi daerah variabel dan konstan.
- Rantai berat terdiri dari lima domain, yang satu variabel, dan empat domain konstan.
Fungsi IgE
- IgE sebagian besar dikaitkan dengan reaksi alergi di mana ia mengikat antigen yang diperkenalkan kembali dan memicu pelepasan agen aktif secara farmakologis.
- Ini juga memainkan peran penting dalam menanggapi alergen dan persiapan antigen yang digunakan dalam imunoterapi desensitisasi.
Aplikasi Antibodi
- Antibodi dapat digunakan untuk mengobati defisiensi imun sebagai alat imunitas pasif.
- Perkembangan antibodi monoklonal telah digunakan untuk mengobati beberapa penyakit seperti multiple sclerosis, rheumatoid arthritis, dan berbagai jenis kanker.
- Antibodi juga dapat digunakan dalam diagnosis medis karena banyak pemeriksaan biokimia memungkinkan deteksi antibodi untuk diagnosis penyakit.
- Kelas imunoglobulin yang berbeda dapat digunakan untuk menganalisis profil antibodi pasien.
- Antibodi juga dapat digunakan sebagai agen pekerja keras dalam penelitian biomedis untuk mempelajari cara kerja antigen yang berbeda dan hubungannya dengan inang.















Tidak ada komentar:
Posting Komentar